Le leggi dei gas ideali: Gay-Lussac, Boyle e la legge generale dei gas
Iniziamo parlando delle proprietà dei gas analizzando una situazione ideale: una scatola dove sono rinchiuse le particelle di un gas, a temperatura e pressione costanti.
In questo articolo tratteremo di gas ideali e defineremo le leggi: isobara, isocora e isoterma unite nella legge generale dei gas.
I gas ideali sono differenti dai gas reali nelle seguenti peculiarità:
- Le particelle vengono considerate punti
- Quando più particelle collidono non viene dispersa energia.
Nonostante ciò, le differenze sono poche, infatti con le opportune correzioni le leggi per gas ideali possono essere adattate in leggi per gas reali, ma questo argomento sarà trattato in future lezioni di fisica.
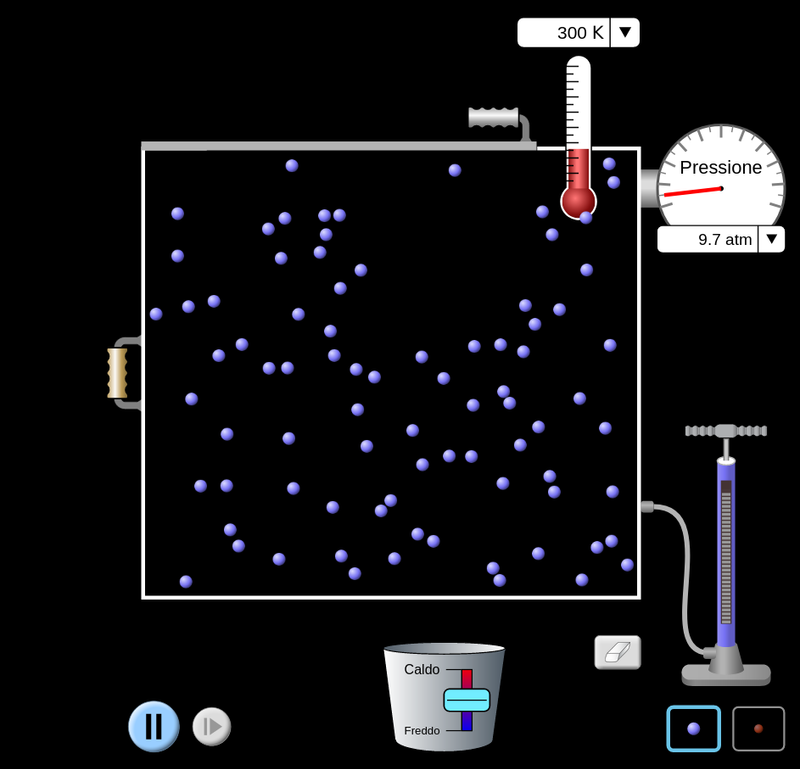
Dimostrazione sperimentale delle leggi dei gas
Queste dimostrazioni si avvalgono della pagina dell’università PhET del Colorado sulle proprietà dei gas.
Notiamo subito che nel caso della macchina soprastante, abbiamo tre parametri che possiamo personalizzare: volume, temperatura e pressione per trovare eventuali relazioni di proporzionalità tra loro, mantendo costante la quantità di sostanza.
Cos’è la pressione?
Nel caso qualcuno se lo sia dimenticato, la pressione è il rapporto tra la forza F esercitata su una superficie e l’area A di essa, ossia $ p = \frac{F}{A} $. In questo caso, la pressione sarà causata dall’insieme degli urti causati dalle particelle del gas sulla superficie del contenitore A, applicando una forza F.
La legge di Gay-Lussac o legge isocora
Intanto, provando a mantenere lo stesso volume, ossia la stessa grandezza del contenitore, noto che aumentando la temperatura le particelle si velocizzano, dunque causano un maggior numero di urti sul contenitore, ossia una maggiore pressione.
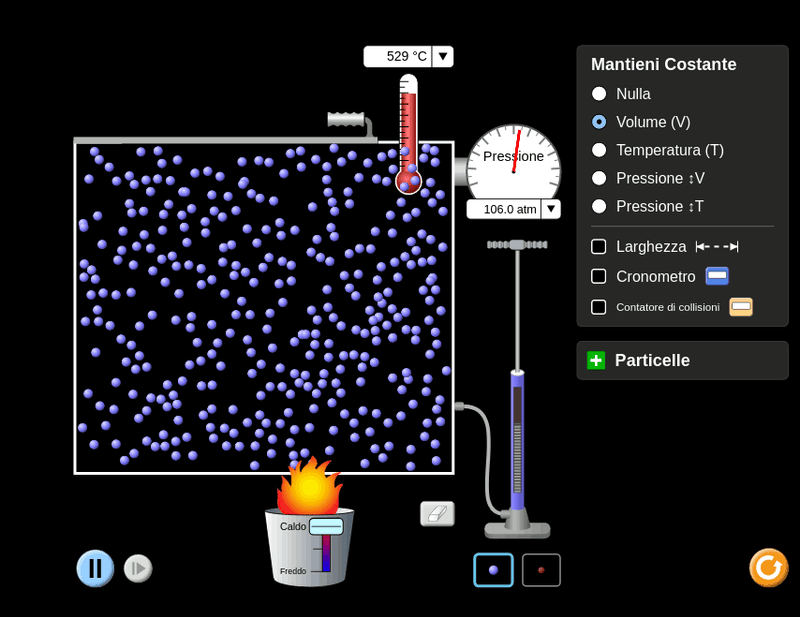
Posso affermare, in base all’osservazione, che temperatura e pressione sono in una relazione di diretta proporzionalità, in caso di volume costante.
\[\frac{p}{T}=k\]Tale relazione fu documentata da Joseph Louis Gay-Lussac, nell’ anno 1802, ed afferma che in caso di volume costante, anche il rapporto tra pressione e temperatura lo è. Il suo enunciato è il seguente:
La pressione di una determinata quantità di gas, a volume costante, è direttamente costante alla temperatura assoluta
La legge di Boyle o legge isoterma
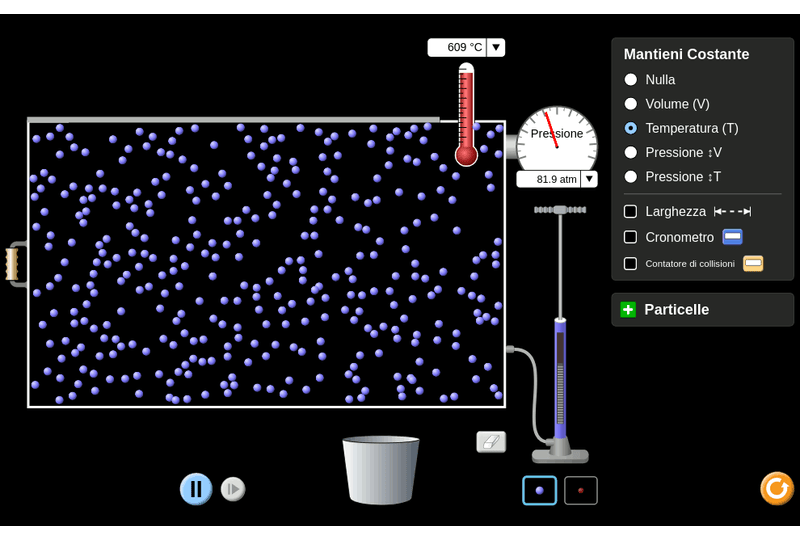
Noto anche che se aumento il volume del contenitore, il numero di urti, come previsto, diminuisce, grazie ad uno spazio maggiore dove le particelle possono muoversi.
Ordunque, pressione e volume sono in relazione di proporzionalità inversa, con temperatura costante.
\[p*V=k \Rightarrow p=\frac{k}{V}\]Questa legge fu ipotizzata da Robert Boyle nell’anno 1662. Egli osservò che comprimendo un gas fino alla metà del suo volume, la pressione raddoppia, comprimendolo ad un terzo, la pressione triplica, e così via. Da queste osservazioni su cui essa si basa, la legge afferma che:
la pressione di una determinata quantità di gas, a temperatura costante, è inversamente proporzionale al volume.
La legge di Charles o legge isobara
Immaginando qua un recipiente con uno stantuffo mobile, come nell’esempio, possiamo notare che la pressione si mantiene costante, ed ad un aumento di temperatura corrisponde un aumento direttamente proporzionale di volume.
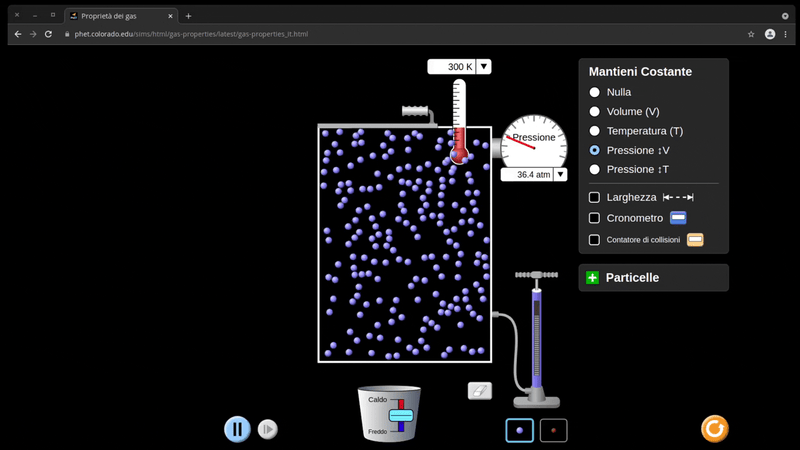
Questo significa che temperatura e volume, a pari pressione, sono in relazione di proporzionalità diretta.
\[\frac{V}{T}=k\]Il volume di una determinata quantità di gas, a pressione costante, è direttamente proporzionale alla temperatura assoluta.
Tale relazione fu elaborata da Jacques Charles nel 1787 e pubblicata da Gay-Lussac qualche anno più tardi.
La legge generale dei gas
Unendo la legge isobora, isocora ed isoterma otteniamo la legge generale dei gas, che descrive il comportamento dei gas puri e vale per qualsiasi quantità di gas, purché essa rimanga costante.
\[\frac{p*V}{T}=k \Rightarrow \frac{p_1*V_1}{T_1}=\frac{p_2*V_2}{T_2}=k\]Questo è il modo in cui è scritta dal nostro libro, anche se la professoressa ci ha fornito una versione diversa, un po’ più approfondita:
\[p*V=T*n*\Bbb{R} \Rightarrow \frac{p*V}{T}=n*\Bbb{R}\]La lettera n indica il numero di particelle, mentre $ \Bbb{R} $ la costante universale dei gas, che approfondiremo in futuro. Questa legge è sempre valida nel caso di gas ideali.
LSS NASCITA DELLA CHIMICA MODERNA:
➤ Calcinazioni con metalli, LSS Nascita della Chimica Moderna
➤ Le ipotesi più rilevanti su calcinazione e combustione tra il XVI e il XVII secolo
➤ Vita di Lavoisier
➤ Le prime scoperte scientifiche di Lavoisier
➤ Esperimenti sulla conservazione della massa durante la combustione
➤ Esperienze di Lavoisier nel 1772
➤ L' aria attiva nella combustione del fosforo
➤ L' aria come miscela di gas
➤ Dimostrazione della legge di conservazione della massa
➤ La gerarchia composizionale della materia
➤ Stavi leggendo: Le leggi dei gas ideali: Gay-Lussac, Boyle e la legge generale dei gas
Questo è il mio sito web personale contenente i Compiti Scolastici e gli appunti presi da me, Andrea Bortolotti, durante il liceo. Ci sono numerose materie, tra cui Fisica, Chimica, Latino, Inglese, Geometria, Storia dell' Arte e tante altre ancora! L' ho creato per essere più ordinato e per non perdere nulla.
CC BY-NC-ND 4.0



