L' aria attiva nella combustione del fosforo
Abbiamo iniziato la nostra lezione con una domanda : “ Perchè nella nostra calcinazione in ambiente chiuso la massa aumenta lo stesso “ Abbiamo semplicemente detto che il nostro crogiolo non era chiuso ermeticamente come quello di Lavoisier ma avevamo solo appoggiato il tappo sopra. Con questo metodo si limita solo l’afflusso di aria, ma non lo si impedisce.
Congetture sull’ aria
Ragionando sugli ultimi esperimenti fatti: - Distillazione - Combustione di zolfo e fosforo - Calcinazione del piombo - candela
siamo arrivati alla conclusione che l’aria è un elemento attivo nella combustione, nella calcinazione e in tutte le trasformazioni chimiche, perciò lo si definisce un reagente.
Come visto dagli esperimenti eseguiti le scorse volte, l’aria non scompare magicamente, ma si lega alla sostanza.
Infatti è solo un’apparenza il fatto che durante la combustione la massa diminuisca. Ciò avviene solamente in ambiente aperto, l’ aria si lega al combustibile e si trasforma in una nuova sostanza che “scompare” sotto forma di gas. Allora è ovvio che il residuo ( cenere ) pesa di meno. Lavoisier si accorse che in ambiente chiuso - dunque conservando il gas - la massa totale non varia.
Da queste supposizioni, Lavoisier formulò una la legge della conservazione della massa:
” La somma della massa dei reagenti è uguale alla somma della massa dei prodotti della trasformazione chimica.”
Esperimento 1: la combustione del fosforo
Lavoisier si interroga sul perché alcune sostanze non continuino la combustione nonostante sia ancora presente l’aria. Un esempio di questo avvenimento inspiegabile è la combustione del fosforo.
Materiali Utilizzati
• Capsula di agata• Grani di fosforo
• Campana di vetro
• Acqua
• Olio
• Imbuto
• Lente d' ingrandimento
• Bacinella
Procedimento
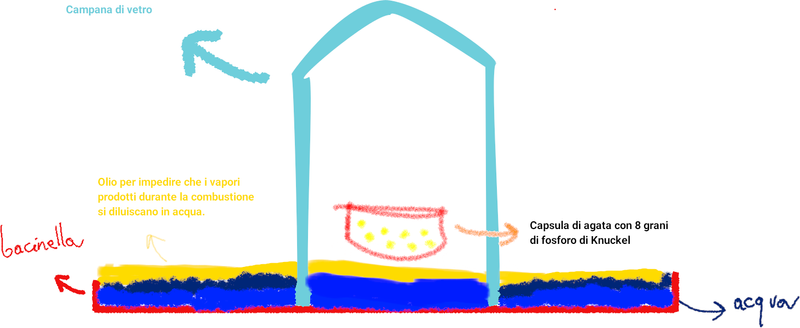
- Inserire la campana di vetro dentro la bacinella
- Inserire i grani di fosforo nella capsula di agata
- Collocare la capsula sotto la campana di vetro
- Inserire l’ acqua nella bacinella
- Aggiungere l’ olio con l’ imbuto ricurvo
- Attraverso un imbuto, formare un piccolo strato di olio sulla superficie dell’ acqua
Ecco una illustrazione del setup, prima di iniziare la combustione
- Con la lente di ingrandimento, concentrare la luce del sole sul fosforo per iniziare la combustione

Osservazioni
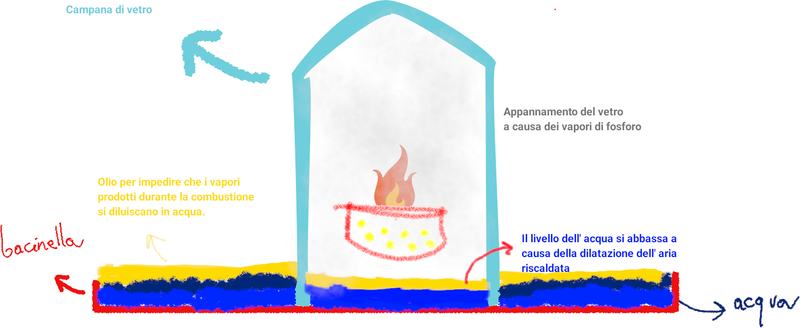
Come visto in precedenza i vapori bianchi appannano le superfici circostanti. Il livello dell’ acqua si abbassa.
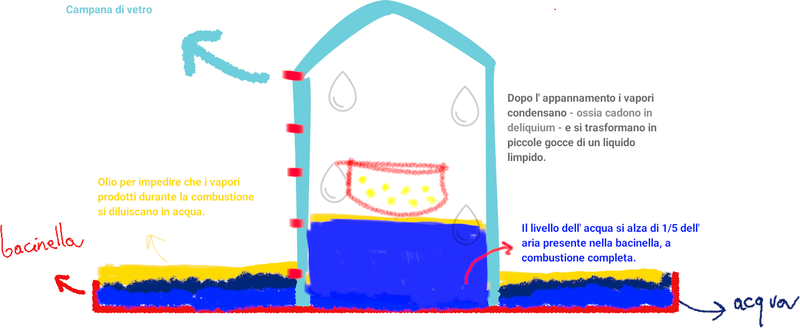
Quando il fosforo smette di bruciare, i vapori bianchi condensano formando delle gocce di un liquido limpido e il livello dell’ acqua si rialza. Il rialzo è di circa 1/5 del volume d’ aria che era presente nella campana di vetro a inizio combustione.
Da queste illustrazioni che ho fatto ( ero assente, purtroppo non ho potuto assistere all’ esperimento ) si può dedurre che:
- Non tutti i grani di fosforo si bruciano
- Il fosforo bruciando emette vapori, che inizialmente appannano le pareti della campana di vetro, poi trasmutano in gocce di un liquido limpido.
Inoltre, alzando la campana, facendo entrare altra aria, poi chiudendola, il processo si ripete, ossia:
- Il fosforo brucia producendo vapori
- Il volume dell’ acqua aumenta di circa 1/5 dell’ aria totale
- Il fosforo smette di bruciare
Queste azioni possono essere ripetute finché resta fosforo da bruciare. ### Riflessioni
L’ aria viene assorbita e l’ acqua prende il suo posto. Il volume dell’ aria assorbita consiste in 1/5 della quantità totale di aria presente nella campana di vetro. #### Come può Lavoisier constatare che ciò che è avvenuto non sia casuale?
Semplicemente ripete l’esperimento con diverse sostanze, fosforo, metalli, zolfo, e i risultati sono gli stessi, anche se la quantità cambia, ad esempio durante la combustione di una candela, solo 1/9 dell’ aria viene “assorbito”
Conclusione di Lavoisier ( 1773 )
Secondo Lavoisier nell’ atmosfera esiste un fluido elastico miscelato con l’ aria, attivo e partecipe ai processi di calcinazione e combustione, senza il quale non si può eseguire, ad esempio, la calcinazione.
Soltanto verso il 1777 Lavoisier arrivò alla conclusione che l’ aria fosse composta da più elementi.
LSS NASCITA DELLA CHIMICA MODERNA:
➤ Calcinazioni con metalli, LSS Nascita della Chimica Moderna
➤ Le ipotesi più rilevanti su calcinazione e combustione tra il XVI e il XVII secolo
➤ Vita di Lavoisier
➤ Le prime scoperte scientifiche di Lavoisier
➤ Esperimenti sulla conservazione della massa durante la combustione
➤ Esperienze di Lavoisier nel 1772
➤ Stavi leggendo: L' aria attiva nella combustione del fosforo
➤ L' aria come miscela di gas
➤ Dimostrazione della legge di conservazione della massa
➤ La gerarchia composizionale della materia
➤ Le leggi dei gas ideali: Gay-Lussac, Boyle e la legge generale dei gas
Questo è il mio sito web personale contenente i Compiti Scolastici e gli appunti presi da me, Andrea Bortolotti, durante il liceo. Ci sono numerose materie, tra cui Fisica, Chimica, Latino, Inglese, Geometria, Storia dell' Arte e tante altre ancora! L' ho creato per essere più ordinato e per non perdere nulla.
CC BY-NC-ND 4.0



